非变性骨骼营养-骨骼健康系列
一、概述
我们的非变性骨骼健康营养产品包括:全骨营养粉、非变性骨骼营养超微粉、非变性骨蛋白钙超微粉和非变性I型胶原蛋白超微粉。这些产品以新鲜、适龄的牛股骨(含关节)为主要原料,确保了胶原蛋白、糖胺聚糖和骨蛋白的高品质。生产过程采用超低温超微化和基于气流原理的超低温分离技术,从而保证了非变性结构的完整性。这保留了成分的功能特性,使其成为支持骨骼健康和组织修复的理想选择。
这些产品独特的非变性特性确保了它们保留天然活性结构,这对于人体充分吸收生物活性化合物至关重要。这项创新技术能够显著提高吸收率和功效,从而更好地支持骨骼和关节健康。
二、组件比例

*胶原蛋白主要由I型胶原蛋白(超过90%)组成,II型胶原蛋白含量较少(不足10%)。
三、天然活性结构
3.1 一级结构
3.1.1 I 型胶原蛋白:主要由 Gly-Pro-X 或 Gly-X-Hyp 重复氨基酸序列(肽键)组成
3.1.2 糖胺聚糖
透明质酸(HA):一种简单的重复线性多糖链,由D-葡萄糖醛酸和N-乙酰葡萄糖胺之间交替的β(1→3)和β(1→4)糖苷键形成。
硫酸软骨素 (CS):一系列微观异质性线性多糖链,其基本骨架由交替连接的 D-葡萄糖醛酸和 N-乙酰半乳糖胺组成,在 N-乙酰半乳糖胺(偶尔还有葡萄糖醛酸)的特定位置具有复杂多变的硫酸化修饰。
3.2 高层结构
3.2.1 I型胶原蛋白
二级结构:α-肽链左旋螺旋结构(主要通过氢键)
三级结构:三螺旋结构(肽键、氢键、范德华力、疏水相互作用、羟醛缩合共价交联)
3.2.2 糖胺聚糖(GAGs)的高级结构
透明质酸的高级结构:在溶液中形成无规卷曲、高度水合的网络。
硫酸软骨素高级结构:与核心蛋白共价结合形成蛋白聚糖。
3.3 超结构(超分子共价交联)
I 型胶原蛋白大分子之间:吡啶啉交联结构。
骨钙素和羟基磷灰石(HAP)之间:钙被γ-羧基谷氨酸螯合。
四、作用机制及效应
全骨营养粉、非变性骨营养超细粉、非变性骨蛋白钙超细粉和非变性 I 型胶原蛋白超细粉不仅提供骨组织生长和修复所必需的全面均衡的营养,而且还提供“活性结构”的益处。
4.1 钙吸收增强的机制和效果
4.1.1 机制:在非变性骨蛋白钙超细粉中,骨钙素与羟基磷灰石(HAP)之间形成超共价结构(γ-羧基谷氨酸螯合钙),该结构受到蛋白质三维结构的保护,避免与胃酸接触。这使得复合物能够完整地到达肠道。在肠道消化酶的作用下,复合物分解成可溶性钙分子,例如γ-羧基谷氨酸螯合钙或小分子肽结合钙。这提高了肠道内钙分子的浓度,从而促进钙通过浓度梯度驱动的细胞旁途径被吸收。
4.1.2 作用:这种吸收依赖于浓度梯度,且与钙结合蛋白 (CaBP) 饱和度无关。对于因生长、发育或衰老导致 CaBP 水平降低,进而造成钙吸收受限的患者,这种吸收方式可实现对钙吸收的生理补偿。
4.2 促进钙骨生成的机制和效果
4.2.1 机制:钙骨生成受血液和骨组织环境中的多种因素调节。
血液环境主要受钙磷浓度积系数的影响。未变性的骨蛋白钙超细粉在肠道内缓慢消化分解为可溶性钙分子,例如γ-羧基谷氨酸螯合钙或小分子肽结合钙,从而实现缓慢吸收。其钙磷比接近2:1,最大程度地提高了钙磷浓度积,促进钙从血液向骨组织的转移。
骨组织环境受三个因素影响:I 型胶原蛋白的 HAP 纳米区、骨钙素中谷氨酸残基的羧化以及桥接蛋白和骨粘附分子的调节。
它所含的非变性I型胶原蛋白片段的三螺旋结构能够激活肠道淋巴系统,调节免疫,抑制炎症反应,并减缓I型胶原蛋白的降解。其降解产物——如交联肽和共轭肽等小分子——通过多种机制(底物、分子伴侣、信号传导)诱导I型胶原蛋白结构的形成。这些降解产物进一步分解为氨基酸单体,直接参与胶原蛋白的合成,为羟基磷灰石(HAP)提供充足的纳米区域,并最大化胶原蛋白-HAP纳米区域的形成。
其未变性的骨蛋白可与钙结合,形成钙结合的γ-羧基谷氨酸或钙结合的小肽。此外,它们还可作为底物或通过信号转导激活γ-羧基谷氨酰羧化酶,催化骨钙素上三个谷氨酸残基的羧化。这提供了钙结合位点,最大限度地增加了钙的附着点。
它所含的非变性结蛋白和非变性骨桥蛋白可以促进相应蛋白质的合成,将 HAP 空间限制在 I 型胶原蛋白内,将胶原蛋白锚定到 HAP 上,并防止骨钙流失。
4.2.2 作用:钙可以进入、储存和停留。
4.3 增加骨蛋白含量的机制和效应
骨蛋白包括胶原蛋白(主要是I型胶原蛋白)和糖蛋白(主要是骨钙素、纤连蛋白、骨连接蛋白以及其他十余种糖蛋白)。提高这些蛋白含量的机制基本相似,例如使用非变性I型胶原蛋白超细粉末。
4.3.1 机制
肠道免疫调节机制:未变性I型胶原蛋白超细粉具有三维结构,可抵抗胃液降解,从而与肠道淋巴系统直接接触。这可激活未成熟T细胞分化为特异性调节性T细胞(Tregs),抑制免疫系统对I型胶原蛋白的错误攻击。它还能促进抗炎因子的分泌,抑制慢性炎症,并减缓I型胶原蛋白的降解。
细胞内酶活性调节机制:未变性的I型胶原蛋白超细粉末含有完整的初级、高共价和超共价交联结构。肠道消化酶选择性地分解初级(肽键)共价交联,同时保留高共价和超共价交联。此过程释放出交联肽和共轭肽等小分子,或作为底物、分子伴侣或信号分子诱导I型胶原蛋白的结构形成。
营养供给:交联肽、共轭肽和其他小分子进一步分解成单个氨基酸,直接参与胶原蛋白合成。
4.3.2 效果
这种双重作用调节——抑制降解同时促进合成——比变性蛋白质或肽的营养供应作用具有显著更高的功效。
4.4 增强糖胺聚糖(GAGs)的机制和效应
4.4.1 机制
非变性糖胺聚糖超细颗粒可递送透明质酸(HA)、硫酸软骨素(CS)和角质素(KS)片段。这些片段易于被消化成低分子量片段、寡糖和二糖单元。它们能够激活软骨细胞,抑制基质降解酶(MMPs 或 ADAMTS),调节免疫,并发挥抗炎和镇痛作用。在细胞内,它们进一步分解成单个糖胺聚糖分子,直接参与 HA、CS 和 KS 的合成。
4.4.2 效果
增加糖胺聚糖含量。
V. 组织衍生
5.1 组织来源的结构决定
非变性营养物质的主要功能(免疫调节、酶活性调节)是通过其天然活性结构实现的。这种结构具有高度特异性,其结构决定了组织来源的特性。
5.2 非变性骨营养系列的组织来源性质
全骨营养粉、非变性骨营养超细粉、非变性骨蛋白钙超细粉和非变性I型胶原蛋白超细粉均以新鲜、适龄的牛胫骨(包括关节)为原料。它们的主要蛋白质是I型胶原蛋白,其组织来源应根据I型胶原蛋白来判断。虽然皮肤组织中的I型胶原蛋白与骨组织具有基因同源性,且氨基酸序列相同,但微环境的差异导致了不同的高级结构和超微结构排列。因此,皮肤组织不被认为是与非变性骨营养系列同源的组织。主要的同源组织包括:硬骨组织、椎间盘、半月板和少量关节软骨。
六、适宜人口
6.1 营养需求:适合所有缺钙人士,特别是婴儿、幼儿和老年人。
6.2 骨骼生长需求:适合在发育阶段需要增高的人以及希望在衰老过程中减缓身高下降的人。
6.2 骨密度增加需求
6.2.1 生长发育期出现佝偻病症状的个体:如囟门闭合延迟、囟门呈方形、扁头、鸡胸、漏斗胸、串珠样改变、O型腿或X型腿、脊柱侧弯等。
6.2.2 中老年人:出现骨增生、身高下降、脊柱后凸、骨质疏松、椎间盘突出等症状的人。
6.3 关节退行性病变修复需求:患有退行性骨关节炎的患者,尤其是那些有半月板损伤或炎症的患者。
6.4 骨损伤愈合需求:骨损伤愈合或骨水泥植入生长等。
非退行性关节营养——关节健康系列
一、概述
关节健康系列非变性营养产品包括:全关节营养粉、非变性关节营养超细粉、非变性软骨营养超细粉和非变性II型胶原蛋白超细粉。所有产品均为功能性食品配料,采用新鲜、适龄牛膝关节或软骨制成。产品按照相关标准,运用超低温超细加工技术(国家专利发明技术)和风箱原理超低温分离技术(专有技术)生产。
二、组件比例

*胶原蛋白主要由 II 型胶原蛋白(90% 以上)组成,I 型胶原蛋白含量较少(10% 以下)。
三、天然活性结构
3.1 一级结构
3.1.1 II型胶原蛋白:主要由Gly-Pro-X或Gly-X-Hyp重复氨基酸序列(肽键)组成
3.1.2 糖胺聚糖
透明质酸(HA):一种简单的重复线性多糖链,由D-葡萄糖醛酸和N-乙酰葡萄糖胺之间交替的β(1→3)和β(1→4)糖苷键形成。
硫酸软骨素(CS):由D-葡萄糖醛酸和N-乙酰半乳糖胺单元交替组成的基本骨架,在微观上具有异质性的线性多糖链,在N-乙酰半乳糖胺(偶尔还有葡萄糖醛酸)单元的特定位置发生复杂多变的硫酸化修饰。
3.2 高层结构
3.2.1 II型胶原蛋白
二级结构:α-肽链左旋螺旋结构(主要通过氢键)
三级结构:三螺旋结构(肽键、氢键、范德华力、疏水相互作用、羟醛缩合共价交联)
3.2.2 糖胺聚糖(GAGs)高级结构
透明质酸高级结构:在溶液中形成无规卷曲、高度水合的网络结构。
硫酸软骨素高级结构:与核心蛋白共价结合形成蛋白聚糖。
3.3 超分子结构(超分子共价交联)
II型胶原蛋白分子间交联:羟基吡啶啉。
骨钙素和羟基磷灰石(HAP):γ-羧基谷氨酸螯合钙。
四、作用机制及效应
全关节营养粉、非变性关节营养超细粉、非变性软骨营养超细粉和非变性 II 型胶原蛋白超细粉不仅为关节组织提供全面均衡的营养,而且还发挥“主动结构”作用。
4.1 促进钙吸收的机制和效果
4.1.1 机制:非变性骨蛋白钙超细粉中骨钙素与羟基磷灰石(HAP)之间的超共价结构(γ-羧基谷氨酸螯合钙)在蛋白质三维结构的保护下避免与胃液接触。这使得钙粉能够完整地到达肠道,并在肠道消化酶的作用下分解成可溶性钙分子,例如γ-羧基谷氨酸螯合钙或小分子肽结合钙,从而提高肠道钙浓度。在浓度梯度作用下,钙通过细胞旁途径被吸收。
4.1.2 作用:这种吸收依赖于浓度梯度,且与钙结合蛋白 (CaBP) 饱和度无关。对于因生长、发育或衰老导致 CaBP 水平降低,进而造成钙吸收受限的患者,这种吸收方式可实现对钙吸收的生理补偿。
4.2 促进钙骨生成的机制和效果
4.2.1 机制:钙骨生成受血液和骨组织环境中的多种因素调节。
血液环境主要受钙磷浓度积系数的影响。未变性的骨蛋白钙超细粉在肠道内缓慢消化分解成可溶性钙分子,例如γ-羧基谷氨酸螯合钙或小分子肽结合钙,从而实现缓慢吸收。其钙磷比接近2:1,最大程度地提高了钙磷浓度积,促进钙从血液向骨组织的转移。
骨组织环境受三个因素影响:I 型胶原蛋白的 HAP 纳米区、骨钙素中谷氨酸残基的羧化以及桥蛋白和骨连接蛋白的调节。
其中未变性的I型胶原蛋白片段可激活肠道淋巴系统,调节免疫,抑制炎症反应,并减缓I型胶原蛋白的降解。其降解产物——如交联肽和共轭肽等小分子——可作为底物、分子伴侣和信号通路,诱导I型胶原蛋白的结构形成。进一步降解为氨基酸单体则直接参与胶原蛋白的合成,为羟基磷灰石(HAP)提供充足的纳米区域,从而最大程度地提高胶原蛋白中HAP纳米区域的含量。
其未变性的骨蛋白与钙结合,形成钙结合的γ-羧基谷氨酸或钙结合的小肽。此外,它们还可以作为底物或通过信号转导激活γ-羧基谷氨酸羧化酶,催化骨钙素上三个谷氨酸残基的羧化。这提供了钙结合位点,最大限度地增加了钙的附着点。
它所含的非变性结蛋白和非变性骨桥蛋白可以促进相应蛋白质的合成,将 HAP 空间限制在 I 型胶原蛋白内,将胶原蛋白锚定到 HAP 上,并防止骨钙流失。
4.2.2 作用:钙进入,被保留,并停留。
4.3 软骨组织修复机制及作用
关节软骨是透明软骨,其主要蛋白质为 II 型胶原蛋白。
4.3.1 机制
肠道免疫调节机制:未变性的II型胶原蛋白超细粉末具有三维结构,可抵抗胃液对其天然活性构象的降解。它到达肠道后,与肠道淋巴系统发生特异性物理相互作用,激活初始T细胞转化为特异性调节性T细胞(Tregs)。Tregs调节效应T细胞,防止对II型胶原蛋白的错误免疫攻击,分泌抗炎因子抑制慢性炎症,并减缓II型胶原蛋白的降解。
器官内酶活性调节机制:未变性的II型胶原蛋白超细粉末含有完整的初级、高级和超高级共价交联结构。肠道消化酶选择性地降解初级(肽键)共价交联,同时保留高级和超高级结构。由此产生的小分子,如交联肽和共轭肽,可作为底物、分子伴侣或信号分子,诱导II型胶原蛋白结构的形成。
营养作用:交联肽和共轭肽等小分子进一步分解成氨基酸,参与 II 型胶原蛋白的合成。
4.3.2 效果
这种双重作用调节——抑制降解同时促进合成——比变性蛋白质或肽介导的作用效果要好得多。
4.4 糖胺聚糖(GAGs)的作用机制及效应
4.4.1 机制
非变性 GAG 超细颗粒可提供 HA、CS 和 KS 的片段,这些片段易于消化成低分子量片段、寡糖和二糖单元。这些片段可激活软骨细胞,抑制基质降解酶(MMPs 或 ADAMTS),调节免疫,并发挥抗炎和镇痛作用。它们还可在细胞内进一步分解成单个糖胺聚糖分子,直接参与 HA、CS 和 KS 的合成。
4.4.2 效果
增加糖胺聚糖含量。
V. 组织衍生
5.1 组织来源的结构决定
非变性营养物质的主要功能(免疫调节、酶活性调节)是通过其天然活性结构实现的。这种结构具有高度特异性,其结构决定了组织来源的特性。
5.2 非变性关节营养系列的组织来源特性
全关节营养粉、非变性关节营养超细粉、非变性软骨营养超细粉和非变性II型胶原蛋白超细粉均以新鲜、适龄的牛膝关节或软骨为原料。其主要蛋白质为II型胶原蛋白,组织来源为富含II型胶原蛋白的软骨组织。主要同源组织包括:关节软骨和少量硬骨。
六、适宜人口
6.1 关节损伤修复需求
6.1.1 退行性骨关节炎修复需求
6.1.2 关节创伤修复需求
非变性皮肤营养——皮肤健康系列
一、概述
皮肤健康系列非变性营养产品包括:全皮营养粉、非变性皮肤营养超细粉和非变性III型胶原蛋白超细粉。所有产品均采用新鲜、适龄的牛皮或驴皮制成。这些产品按照相关标准,运用超低温超微粉化技术(国家专利发明技术)和风箱原理超低温分离技术(专有技术)生产,属于非变性功能性食品配料。
二、配料比例

三、天然活性结构
3.1 一级结构
3.1.1 I/III 型胶原蛋白:主要由 Gly-Pro-X 或 Gly-X-Hyp 重复氨基酸序列(肽键)组成
3.1.2 糖胺聚糖
透明质酸(HA):一种简单的重复线性多糖链,由D-葡萄糖醛酸和N-乙酰葡萄糖胺之间交替的β(1→3)和β(1→4)糖苷键形成。
硫酸软骨素(CS):由D-葡萄糖醛酸和N-乙酰半乳糖胺单元交替组成的基本骨架,在微观上具有异质性的线性多糖链,在N-乙酰半乳糖胺(偶尔还有葡萄糖醛酸)单元的特定位置发生复杂多变的硫酸化修饰。
3.2 高层结构
3.2.1 I/III型胶原蛋白
二级结构:α-肽链左旋螺旋结构(主要通过氢键)
三级结构:三螺旋结构(肽键、氢键、范德华力、疏水相互作用、羟醛缩合共价交联)
3.2.2 糖胺聚糖(GAGs)的高级结构
透明质酸的高级结构:在溶液中形成无规卷曲、高度水合的网络。
硫酸软骨素的高级结构:核心蛋白以共价键结合形成蛋白聚糖。
3.3 超结构(超分子共价交联)
I 型胶原蛋白分子间交联:羟赖氨酸吡啶啉和赖氨酸吡啶啉。
四、作用机制及效应
全效皮肤营养粉、非变性皮肤营养超细粉和非变性 III 型胶原蛋白超细粉不仅提供皮肤组织生长和修复所必需的全面均衡的营养,而且还能发挥“活性结构”的作用。
4.1 胶原蛋白增强机制及作用
4.1.1 机制
肠道免疫调节机制:未变性的I/III型胶原蛋白超细粉具有三维结构,能够抵抗胃液对其天然活性结构的降解。它到达肠道后,与肠道淋巴系统发生物理相互作用,激活初始T细胞转化为特异性调节性T细胞(Tregs)。Tregs调节效应T细胞,防止其对未变性的I/III型胶原蛋白产生错误的免疫攻击,分泌抗炎因子以抑制慢性炎症,并减缓未变性I/III型胶原蛋白的降解。
细胞内酶活性调控机制:未变性的I/III型胶原蛋白超细粉含有完整的初级、高级和超高级共价交联结构。肠道消化酶能够特异性地选择并分解初级(肽键)共价交联结构,同时保留高级和超高级共价交联结构。这一过程产生交联肽和共轭肽等小分子,这些小分子随后通过多种途径诱导I/III型胶原蛋白结构的形成,包括作为底物、分子伴侣或信号分子。
营养功能:交联肽和共轭肽等小分子可以进一步分解成单个氨基酸分子,直接参与胶原蛋白合成。
4.1.2 效果
这种双重作用调节——抑制降解同时促进合成——比变性蛋白质或肽提供的营养功能具有显著更高的功效。
4.2 增强糖胺聚糖(GAGs)的机制和效果
4.2.1 机制
非变性糖胺聚糖超细颗粒可提供HA和CS片段,这些片段易于消化成低分子量片段、寡糖和二糖单元。这些片段可抑制基质降解酶(MMPs或ADAMTS),调节免疫反应以发挥抗炎和镇痛作用,并可在细胞内进一步分解成单个糖胺聚糖分子,直接参与HA和CS的合成。
4.2.2 效果
增强糖胺聚糖含量。
V. 组织衍生特性
5.1 由结构决定的组织衍生特性
非变性营养物质的主要功能(免疫调节、酶活性调节)是通过其天然活性结构实现的。这种结构具有高度特异性,其组成决定了组织来源的特性。
5.2 非变性皮肤营养系列的组织衍生特性
全皮营养粉、非变性超细皮营养粉和非变性III型胶原蛋白超细粉均采用新鲜、适龄的驴皮或牛皮作为原料。它们的主要蛋白质是I型和III型胶原蛋白,其组织来源为富含这两种胶原蛋白的皮肤组织。主要同源组织为:皮肤组织。
六、适宜种群
6.1 皮肤抗衰老
6.2 皮肤损伤修复
非变性脑营养——大脑健康
一、概述
非变性脑神经营养超细粉是一种由新鲜牛脑或猪脑制成的非变性功能性食品配料。它采用超低温超细研磨(国家专利发明技术)和风箱原理超低温分离技术(专有技术),按照相关标准生产。
二、组件比例
2.1 一般分类
水、脂质、蛋白质、无机盐和其他关键分子。无机盐和关键分子的浓度非常低。

2.2 蛋白质组成
脑蛋白约占干重的30%,可按功能分类:
2.2.1 结构蛋白:微管蛋白、微丝(肌动蛋白)、神经丝蛋白。
2.2.2 突触相关蛋白:离子通道蛋白、神经递质受体蛋白、囊泡相关蛋白、支架蛋白。
2.2.3 髓鞘相关蛋白:髓鞘碱性蛋白、蛋白脂蛋白、髓鞘相关糖蛋白。
2.2.4 代谢和能量相关蛋白:线粒体蛋白、己糖激酶、烯醇化酶
2.2.5 神经营养因子:
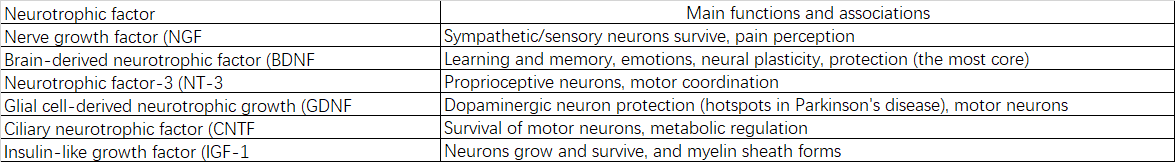
2.2.6 信号蛋白: G蛋白、蛋白激酶、磷酸酶等。
2.2.7 疾病相关蛋白: β-淀粉样蛋白、tau蛋白、α-突触核蛋白。
2.3 脂质组成
2.3.1 磷脂:脑苷脂、磷脂酰肌醇、磷脂酰丝氨酸、鞘磷脂、卵磷脂等。
2.3.2 胆固醇
2.2.3 中性脂肪
磷脂和中性脂肪中含有特定的脂肪酸:饱和脂肪酸约占 30%以上,而高度不饱和脂肪酸约占 60%以上(ARA、DHA、ALA、EPA)。
三、脑蛋白与衰老的关系
大脑衰老不是一个单一事件,而是一个系统性的、渐进的过程,涉及大脑蛋白质稳态网络的逐渐失衡、功能性蛋白质的逐渐消耗以及异常蛋白质的逐渐积累。
3.1 蛋白质稳态网络的全面衰退
维持蛋白质质量控制的三大主要细胞系统均表现出功能衰退:
3.1.1 蛋白质合成和折叠效率降低
衰老细胞的蛋白质合成速率和保真度下降,增加了产生错误折叠蛋白质的可能性。
应激诱导的分子伴侣反应变得不那么有效,无法正确地帮助新合成的蛋白质正确折叠或修复受损的蛋白质。
3.1.2 蛋白质降解系统能力下降
泛素-蛋白酶体系统活性降低,无法及时清除受损或错误折叠的蛋白质;蛋白酶体的组装也受到氧化损伤的损害,加速其功能衰退。
自噬-溶酶体系统,特别是巨自噬和分子伴侣介导的自噬,效率显著降低。这阻碍了异常蛋白聚集体和受损细胞器(例如线粒体)的有效清除。
3.1.3 蛋白质运输和分布受损
结构蛋白功能障碍会阻止突触所需的蛋白质和线粒体有效地输送到远端,同时废物也无法及时运回细胞体进行处理。
3.2 异常蛋白质的积累和毒性
体内平衡网络的失灵导致各种“废物蛋白”在大脑中逐渐积累,直接损害神经元。
3.2.1 错误折叠和易聚集蛋白质的积累
出现可溶性蛋白质寡聚体,例如β-淀粉样蛋白、tau蛋白和α-突触核蛋白。
3.2.2 异常翻译后修饰蛋白质的积累
AGEs修饰的蛋白质:晚期糖基化终产物在衰老的大脑中积累,导致蛋白质交联、僵硬、功能丧失和炎症通路激活。
过度磷酸化的 Tau 蛋白:正常的 Tau 蛋白从微管上脱离,失去了稳定细胞骨架的功能。
3.3 关键功能蛋白的缺失
除了“废物”增加外,“有用”的蛋白质也会减少或失效。
3.3.1 突触相关蛋白减少
关键的突触前蛋白(如突触素、SNAP-25)和突触后蛋白(如PSD-95、NMDA/AMPA受体)的下调直接导致突触结构萎缩和功能下降,从而构成学习和记忆受损的直接分子基础。
3.3.2 神经营养因子及其受体减少
脑源性神经营养因子 (BDNF)、神经生长因子 (NGF) 等的合成和信号传导减弱,导致神经元存活、生长和可塑性所需的支持信号不足。
3.3.3 DNA修复蛋白和端粒酶活性降低
这会导致基因组不稳定和细胞衰老,损害神经元的长期存活。
3.4 系统性后果
上述蛋白质水平的变化会引发一系列反应,最终导致大脑衰老:
3.4.1 线粒体功能障碍:受损蛋白质在线粒体中积累,减少 ATP 产生并加剧氧化应激。
3.4.2 慢性神经炎症:神经胶质细胞(小胶质细胞和星形胶质细胞)被异常蛋白质(例如 Aβ 寡聚体)持续激活,通过释放促炎因子损害健康神经元,从“守护者”转变为“破坏者”。
3.4.3 突触可塑性丧失:关键蛋白质的失衡会削弱长期增强作用,损害记忆的形成和巩固。
3.4.4 神经网络效率降低:白质中髓鞘蛋白的损伤和轴突运输受损会减慢大脑区域之间的信息传递,并降低同步性。
3.4.5 自噬和细胞凋亡失调:最终导致选择性神经元丢失,尤其是在海马体和前额叶皮层等关键区域。
四、非退行性脑营养的作用机制及效果
非退行性脑部营养不仅提供脑组织生长和修复所必需的全面均衡的营养素——包括蛋白质、磷脂、透明质酸、α-亚麻酸、二十碳五烯酸等——更重要的是,它还能提供这些营养素的天然活性结构。这些结构除了提供营养外,还具有其他特殊功能。
4.1 抑制功能性脑蛋白降解
机制:未变性的脑神经营养超细粉末的三维结构使其能够抵抗胃液的降解,从而与肠道和肠道淋巴系统直接接触。这可以激活未成熟的T细胞,使其转化为特异性的调节性T细胞(Tregs)。Tregs调节效应T细胞,防止其对脑蛋白的错误免疫攻击,分泌抗炎因子以抑制慢性炎症,并减缓脑蛋白的降解。
4.2 促进脑蛋白的结构形成和异常修复
机制:未变性的脑神经超细粉末含有完整的初级和次级共价交联结构。肠道消化酶选择性地分解初级(肽键)共价交联,同时保留次级共价交联。这一过程产生交联肽和共轭肽等小分子,或作为特定酶的底物增强其催化活性;或作为分子伴侣修复异常结构;或通过信号转导等多种途径诱导脑蛋白结构形成和异常结构修复。
4.3 营养供应
机制:交联肽和共轭肽等小分子可以进一步分解成单个氨基酸,直接参与脑蛋白质合成。
4.4 效果
这种抑制降解和促进合成的双重调节作用,比变性蛋白质或肽的营养供应作用具有显著更高的功效。
V. 组织衍生
5.1 组织来源的结构依赖性调控
非变性营养物质的主要功能(免疫调节、活性调节)是通过天然活性结构实现的。这些结构具有高度特异性,仅对具有相同结构的蛋白质发挥调节作用。
5.2 相应的组织来源
非变性脑营养剂采用新鲜的牛或猪脑组织,包括大脑、中脑和小脑。因此,其蛋白质结构与大脑、中脑和小脑中的蛋白质结构同源。
六、适宜种群
6.1 需要大脑生长和发育的个体:婴儿、幼儿以及需要大脑和神经发育支持的个体。
6.2 寻求大脑抗衰老或解决大脑功能障碍的个体。
非变性肌肉蛋白 - 肌肉健康
一、概述
非变性肌肉蛋白超细粉是一种非变性功能性食品配料,由新鲜牛里脊肉或鸡胸肉制成。它采用超低温超细研磨(国家专利技术)和基于空气柜原理的超低温分离技术(专有技术),按照相关标准生产。
二、组成比例和函数
2.1 一般分类

2.2 蛋白质组成和功能
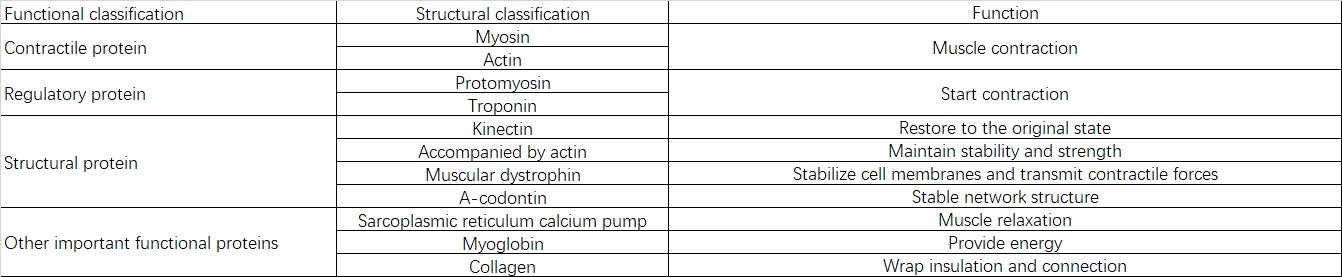
三、肌少症的病因
肌少症的核心是骨骼肌质量、力量和功能的逐渐丧失,这是由多种相互关联的因素造成的。
3.1 蛋白质合成与降解失衡(核心病理)
3.1.1 简化合成
肌肉蛋白质合成率随年龄增长而下降。即使受到刺激(例如通过营养/运动),合成反应也会减弱,最终导致合成抵抗。
3.1.2 降解加剧
泛素-蛋白酶体系统和自噬-溶酶体系统的过度激活,以及 Atrogin-1 和 MuRF1 等基因的上调。
3.2 激素和信号通路失调
3.2.1 合成代谢激素减少
生长激素/胰岛素样生长因子-1轴严重受损。
性激素(睾酮/雌激素)水平降低。
3.2.2 抑制合成代谢途径:
胰岛素抵抗:肌肉对氨基酸的吸收和利用效率降低。
抑制关键合成代谢途径:例如,mTOR信号通路激活能力降低。
肌肉生长抑制素增加:抑制肌肉生长。
增强的分解代谢信号:糖皮质激素的相对或绝对增加会促进蛋白质分解。
3.3 慢性炎症
衰老伴随着全身性的、慢性的、低度的炎症,以及促炎细胞因子(如IL-6、TNF-α)的升高。
四、作用机制及效应
非变性肌肉蛋白超细粉不仅提供肌肉生长所需的全面均衡的营养,而且还具有“活性结构”特性。
4.1 降解抑制机制及效应
机制:未变性肌肉蛋白微粉含有多种具有完整三维结构的未变性肌肉蛋白。这些蛋白能够抵抗胃液的降解,完整地到达小肠。它们被M细胞吞噬,从而与肠道淋巴系统发生特异性的物理接触,激活未成熟的T细胞转化为特定的调节性T细胞(Treg)。这可以调节效应T细胞对各种肌肉蛋白的错误攻击,分泌抗炎因子,并抑制慢性炎症。
作用:减缓肌肉蛋白质分解。
4.2 促进合成的机制和效果
机制:未变性肌肉蛋白超细粉末含有完整的初级和高级共价交联结构。肠道消化酶能够特异性地选择并分解初级(肽键)共价交联结构,同时保留高级共价交联。由此产生的小分子,例如交联肽和共轭肽,可以通过多种方式调节蛋白酶的催化活性——作为底物、分子伴侣或信号分子——从而增强肌肉蛋白质的合成。进一步降解为单个氨基酸后,这些氨基酸可以直接参与肌肉蛋白质的合成。
作用:促进肌肉合成。
这种双重作用调节——抑制降解同时促进合成——比变性蛋白质或肽的功效要高得多。
V. 组织衍生
5.1 组织衍生结构决定
非变性营养物质的主要功能(免疫调节、活性调节)是通过天然活性结构实现的。这些结构具有高度特异性,仅对具有相同结构的蛋白质发挥调节作用。
5.2 组织特异性起源
非变性肌肉营养成分来源于牛筋或鸡胸肉,两者均为骨骼肌组织。牛筋的结构相似度为95%,鸡胸肉的结构相似度为85%。
六、适宜种群
6.1 运动员:从事力量训练和肌肉锻炼的个人。
6.2 肌少症:抑制肌肉分解并促进肌肉合成。
非变性脾脏蛋白——免疫健康
一、概述
非变性脾蛋白超细粉是一种以新鲜牛脾为原料制成的非变性功能性食品配料。它采用超低温超细加工技术(国家发明专利)和基于风箱原理的超低温分离技术(专有技术),并符合相关标准。
二、元件比例和功能

2.1 核心免疫应答蛋白复合物的组成和功能
2.1.1 免疫相关蛋白(核心功能复合物):脾脏蛋白中最具特色和功能性的部分。
成分:抗体(免疫球蛋白 IgG、IgM 等)及其片段。
功能:体液免疫的核心执行者。
2.1.2 主要组织相容性复合体蛋白
组成:MHC I 类和 MHC II 类分子,广泛表达于抗原呈递细胞表面。
功能:捕获病原体蛋白片段(抗原)并将其“呈递”给 T 淋巴细胞。
2.1.3 补体系统蛋白
成分:多种补体成分,包括 C3、C4 和补体激活剂。
功能:形成“补体膜攻击复合物”直接穿透病原体膜;作为“趋化因子”吸引免疫细胞至感染部位;标记病原体以促进吞噬作用(补体活性)。
2.1.4 细胞因子和趋化因子
成分:白细胞介素、干扰素、肿瘤坏死因子等。
功能:作为免疫细胞之间的“信号分子”,精确地指导免疫反应的启动、增强、抑制或终止,并协调各种免疫细胞类型的行为。
2.1.5 模式识别受体
组成成分:Toll样受体等。
功能:识别病原体的保守分子模式,以启动快速的先天免疫反应。
2.2 参与红细胞加工的蛋白质
2.2.1 血红蛋白降解酶
成分:血红素加氧酶、胆绿素还原酶等。
功能:分解衰老红细胞中的血红蛋白,释放铁离子以供再利用,并将血红素转化为胆红素。
2.2.2 铁储存和运输蛋白
组成成分:铁蛋白是其中最重要的代表。
功能:安全有效地储存和缓冲铁,防止游离铁产生有害的自由基,并根据身体需要释放铁。
2.3 结构蛋白和支架蛋白
组成成分:细胞外基质蛋白(如胶原蛋白、纤连蛋白)和细胞粘附分子。
功能:形成脾脏白髓(动脉周围淋巴鞘、淋巴滤泡)和红髓的物理支架;介导淋巴细胞归巢、滞留和免疫细胞之间的相互作用。
2.4 代谢和抗氧化酶
2.4.1 抗氧化酶
成分:超氧化物歧化酶、过氧化氢酶、谷胱甘肽过氧化物酶。
功能:清除活性氧(ROS),保护脾脏组织免受氧化损伤。
2.4.2 核苷酸代谢酶
成分:嘌呤核苷磷酸化酶等。
功能:参与淋巴细胞内的嘌呤代谢,对免疫细胞功能至关重要。
2.5 信号转导和调控蛋白
组成成分:转录因子,包括 NF-κB、STAT 家族蛋白等。
功能:接收细胞因子等信号,转位到细胞核内调节特定基因表达,并决定免疫细胞的激活、增殖或分化命运。
三、作用机制及效应
非变性脾脏蛋白超细粉可提供完整、天然构象保持的脾脏蛋白。其核心机制并非提供营养,而是作为一种复杂的天然生物活性分子库发挥作用。它为机体(尤其是免疫系统)提供调节信号和功能模块,从而发挥“营养免疫”作用。
3.1 局部肠道免疫效应
3.1.1 被动免疫效应
未变性的脾脏蛋白超细颗粒含有丰富的免疫球蛋白,这些免疫球蛋白在结构保护下完整地到达肠道。它们的抗原结合片段(Fab区)可维持一段时间的活性,发挥局部被动免疫作用。这些Fab片段可以:- 直接中和特定的病毒、细菌及其毒素,使其丧失感染或毒性能力;- 黏附于病原体以阻止其入侵;- 与病原体或抗原形成复合物,刺激肠道蠕动并促进黏液包裹,加速病原体或抗原随粪便排出,从而减少其在肠道内的滞留时间和损害。
3.1.2 维持肠道屏障功能
减少炎症损伤:通过快速清除病原体和毒素,减少对肠道上皮细胞的直接攻击以及由此产生的过度炎症反应,从而保护肠道屏障的完整性。
支持修复:一些研究表明,免疫球蛋白制剂中的其他成分(如生长因子)或抗体本身可能间接促进粘膜修复。
3.1.3 调节局部免疫环境
抗原缓冲:在人体最大的免疫器官——肠道内,过量的外源性抗原(包括食物和病原体抗原)可能引发异常的免疫反应。口服免疫球蛋白可以结合并清除部分抗原,减轻肠道免疫系统的负担,降低错误攻击的风险,从而有助于维持免疫耐受平衡。
抗炎作用:通过上述机制减少病原体刺激,下调促炎细胞因子的产生,创造更有利于组织修复和微生物平衡的局部环境。
3.2 系统性免疫调节作用
3.2.1 诱导外周免疫耐受作为抗原
脾脏含有天然的、未变性的免疫相关蛋白质和抗原。这些物质可被肠道免疫系统识别为“友好且熟悉的免疫刺激物”,从而增强免疫警觉性和反应性,而不会引发强烈的炎症反应(口服耐受途径)。
3.2.2 直接提供免疫活性成分和信号分子
在肠道内释放具有免疫调节活性的小分子肽。这些肽片段作为信号分子,可被肠道免疫细胞(例如派氏淋巴集结中的细胞)识别,从而温和地刺激和训练免疫系统——类似于“免疫演练”。
3.2.3 与免疫信息库的交互
诱导口服耐受性的潜力:对于某些自身免疫倾向,理论表明,摄入含有自身相似抗原的组织可能有助于诱导免疫耐受性。
IV. 组织来源
4.1 组织衍生结构依赖性
非变性营养物质的主要功能(免疫调节、活性调节)是通过天然活性结构实现的。这些结构具有高度特异性,仅对具有相同结构的蛋白质发挥调节作用。
4.2 相应组织来源
脾脏富含各种免疫细胞和因子,其组织来源与免疫组织相对应。
五、适宜的种群
5.1 免疫功能低下者
5.2 患有消化系统疾病的个体
非变性弹性蛋白——血管健康
一、概述
非变性弹性蛋白超细粉是一种非变性功能性食品配料,由新鲜牛颈韧带或牛主动脉制成。它采用超低温超微粉化(国家专利发明技术)和基于风箱原理的超低温分离技术(专有技术),按照相关标准生产。
二、组件比例
2.1 非变性超细弹性蛋白粉(牛颈韧带)及其冻干粉的组成

2.2 非变性超细弹性蛋白粉(牛主动脉)及其冻干粉的组成

三、天然活性结构
3.1 一级结构
弹性蛋白氨基酸序列由交替的疏水片段(富含缬氨酸、丙氨酸、甘氨酸和脯氨酸)和交联片段(富含赖氨酸和丙氨酸)串联排列而成。
3.2 更高层的结构
弹性蛋白的氨基酸序列无序,无法形成规则的二级结构,缺乏传统的II级、III级或IV级结构。相反,它通过共价交联(例如弹性蛋白交联)形成三维无序网络聚合物。
四、作用机制及效应
弹性蛋白是一种非营养性蛋白质,其主要功能不是提供氨基酸,而是其独特的“天然活性结构”,这种结构能够发挥结构作用。
4.1 外周免疫调节机制及作用
4.1.1 机制:未变性弹性蛋白特有的多维结构可激活派氏淋巴集结淋巴样T细胞分化为特异性调节性T细胞(Tregs)。这可调节免疫系统对内源性弹性蛋白的错误攻击,并抑制炎症反应。
4.1.2 作用:减缓弹性蛋白降解。随着年龄增长(大约从25-30岁开始),人体合成弹性蛋白的能力急剧下降。同时,由于免疫失调,现有的弹性蛋白纤维会因糖化、氧化应激(自由基损伤)和酶促降解(例如,基质金属蛋白酶)而发生断裂、僵硬和功能障碍。这是人体血管硬化的主要原因。
4.2 作为细胞信号分子(最显著的功能)
4.2.1 机制:完整的弹性蛋白分子表面含有特定的生物活性结构域(例如,细胞结合结构域、趋化结构域)。当这些结构域保持其天然构象时,它们可以特异性地与成纤维细胞、内皮细胞和其他细胞表面的受体(例如,弹性蛋白结合蛋白)结合。这种结合会向细胞发出信号,刺激其自身合成更多的胶原蛋白、弹性蛋白和透明质酸。这一过程诱导内源性再生,其意义远大于仅仅提供原材料。
4.2.2 作用:有助于从根本上改善弹性和紧致度,恢复血管等组织的弹性。
4.2 作为调节酶活性的底物
4.2.1 机制:未变性的弹性蛋白可在肠道内分解成含有初级和次级共价交联结构的交联肽。这些交联肽可作为相关结构修饰酶的底物,从而上调这些酶的催化活性。
4.2.2 作用:促进弹性蛋白结构的形成或修复。
4.3 作为结构模板和支架
4.3.1 机制:未变性的弹性蛋白保留了大的组织片段和未变性的交联结构,可在体外或体内发挥“引导支架”的作用。它引导新合成的弹性蛋白前体分子有序排列并正确交联,从而促进功能性新型弹性纤维网络的形成。
4.3.2 功效:有助于修复因光老化或衰老而断裂、紊乱的弹性纤维。
V. 组织衍生
5.1 组织衍生结构依赖性
非变性蛋白的功能(免疫调节、活性调节)取决于其结构。它们的结构具有高度特异性,仅调节具有相同结构的蛋白质。
5.2 相应的组织来源
富含弹性蛋白的组织,例如血管、皮肤和肺泡。
六、合适的候选人
6.1 血管健康:高血压、高脂血症、动脉粥样硬化。
6.2 皮肤抗皱:皮肤松弛、皱纹、失去弹性。
6.3 肺功能不全:肺气肿、慢性阻塞性肺病(COPD)等患者。






